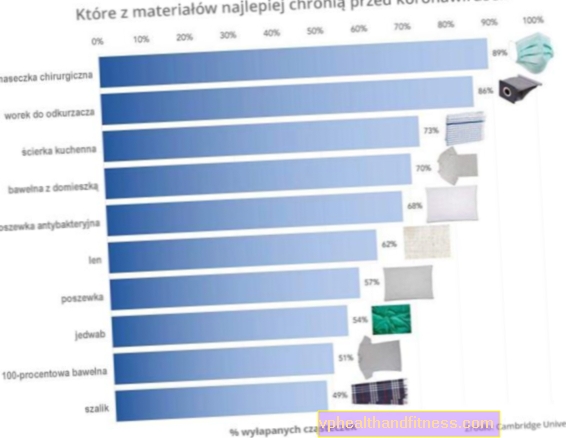
1 ml dung dịch chứa 1 mg galsulfase. Chế phẩm có chứa natri.
| Tên | Nội dung của gói | Hoạt chất | Giá 100% | Sửa đổi lần cuối |
| Naglazyme | 1 lọ 5 ml, cuối cùng để chuẩn bị giải pháp để inf. | Galsulfase | 2019-04-05 |
Hoạt động
Một loại thuốc ảnh hưởng đến đường tiêu hóa và các sản phẩm chuyển hóa. MPS VI là một rối loạn không đồng nhất và đa hệ thống được đặc trưng bởi sự thiếu hụt 4-sulfatase-N-acetylgalactosamine, một hydrolase lysosome xúc tác quá trình thủy phân các gốc glycosaminoglycan sulfat Dermatan sulfat. Hoạt động của enzym giảm hoặc thiếu dẫn đến sự tích tụ của dermatan sulfat trong nhiều loại tế bào và mô. Cơ sở lý luận của liệu pháp là khôi phục hoạt động của enzym đủ để thủy phân chất nền đã tích lũy và ngăn chặn sự tích tụ thêm của nó. Cmax là 2357 (± 1560) ng / ml, T0,5 trung bình trong giai đoạn thải trừ là 22,8 (± 10,7) phút ở tuần 24. Galsulfase trải qua quá trình thủy phân peptide. Sự bài tiết galsulfase ở thận góp phần nhỏ vào quá trình thải trừ thuốc ra khỏi cơ thể.
Liều lượng
Điều cần thiết là bắt đầu điều trị càng sớm càng tốt trước khi xuất hiện các triệu chứng lâm sàng không thể đảo ngược của bệnh. Việc điều trị phải dưới sự giám sát của bác sĩ có kinh nghiệm trong việc quản lý bệnh nhân MPS VI hoặc các bệnh chuyển hóa di truyền khác. Naglazyme nên được sử dụng trong một cơ sở lâm sàng thích hợp với khả năng tiếp cận ngay với thiết bị hỗ trợ sự sống để điều trị các trường hợp khẩn cấp đe dọa tính mạng. Liều khuyến cáo của galsulfase là 1 mg / kg thể trọng. truyền tĩnh mạch mỗi tuần một lần trong 4 giờ. Người cao tuổi: Tính an toàn và hiệu quả của chế phẩm chưa được thiết lập và không có khuyến nghị về lịch dùng thuốc thay thế. Rối loạn thận và gan: Chưa đánh giá được tính an toàn và hiệu quả của chế phẩm và không có khuyến nghị về lịch dùng thuốc thay thế cho những bệnh nhân này. Trẻ em và thanh thiếu niên: không có quy tắc đặc biệt nào cần được xem xét khi sử dụng chế phẩm ở nhóm bệnh nhân này. Phương pháp sử dụng: Tốc độ truyền ban đầu có thể được điều chỉnh sao cho truyền khoảng 2,5% tổng dung dịch trong 1 giờ và thể tích còn lại (khoảng 97,5%) được truyền trong 3 giờ tiếp theo. Ở những bệnh nhân dễ bị quá tải thể tích dịch và cân nặng dưới 20 kg, cân nhắc việc sử dụng túi truyền 100 ml. Trong trường hợp này, nên giảm tốc độ truyền (ml / phút) để tổng thời gian truyền không dưới 4 giờ.
Chỉ định
Thay thế enzym lâu dài ở những bệnh nhân được chẩn đoán xác định mắc bệnh mucopolysaccharidosis loại VI (MPS VI; thiếu hụt N-acetylgalactosamine 4-sulfatase; hội chứng Maroteaux-Lamy). Điều trị chủ yếu là điều trị bệnh nhân trẻ <5 tuổi bị bệnh nặng, mặc dù bệnh nhân <5 tuổi không tham gia vào nghiên cứu giai đoạn 3 tập trung. Dữ liệu hạn chế có sẵn ở bệnh nhân <1 tuổi.
Chống chỉ định
Quá mẫn cấp tính hoặc đe dọa tính mạng với hoạt chất hoặc với bất kỳ tá dược nào, nếu quá mẫn không thể kiểm soát được.
Các biện pháp phòng ngừa
Cần thận trọng trong việc quản lý và điều trị bệnh nhân bị bệnh phổi hạn chế, hoặc theo dõi cẩn thận việc sử dụng thuốc kháng histamine và các thuốc an thần khác. Nên xem xét việc sử dụng áp lực dương trong khi ngủ và khả năng mở khí quản khi thích hợp về mặt lâm sàng. Có thể phải hoãn việc truyền thuốc ở những bệnh nhân bị sốt cấp tính hoặc có vấn đề về hô hấp. Do khả năng xảy ra các phản ứng liên quan đến truyền dịch (IAR), được hiểu là bất kỳ phản ứng có hại nào xảy ra trong quá trình truyền hoặc trước khi kết thúc ngày truyền, nên bệnh nhân được khuyến cáo trước khi dùng thuốc kháng histamine kết hợp với thuốc hạ sốt. hoặc không có chúng, khoảng 30-60 phút. trước khi bắt đầu truyền chế phẩm để giảm nguy cơ mắc các triệu chứng IAR. Đối với các triệu chứng nhẹ đến trung bình của IAR, hãy xem xét điều trị bằng thuốc kháng histamine và paracetamol và / hoặc giảm tốc độ truyền xuống dưới một nửa tốc độ đáp ứng. Trong trường hợp có các triệu chứng nghiêm trọng đơn lẻ của IAR, nên ngừng truyền dịch cho đến khi hết triệu chứng và nên cân nhắc điều trị bằng thuốc kháng histamine và paracetamol. Quá trình truyền có thể được bắt đầu lại ở 50% -25% tốc độ mà nó đã đáp ứng. Đối với các triệu chứng IAR vừa tái phát hoặc điều trị lại sau các triệu chứng IAR nặng đơn lẻ, hãy cân nhắc việc điều trị trước (với thuốc kháng histamine và paracetamol và / hoặc corticosteroid) và giảm tốc độ truyền xuống 50% -25% tốc độ đã xảy ra phản ứng trước đó. Có thể xảy ra các phản ứng mẫn cảm kiểu dị ứng nghiêm trọng, nếu chúng xảy ra, nên ngừng ngay chế phẩm và thực hiện điều trị thích hợp. Các quy tắc áp dụng để giải quyết tình huống khẩn cấp phải được tuân thủ. Những bệnh nhân đã bị phản ứng dị ứng trong quá trình truyền thuốc nên được đặc biệt thận trọng thử lại; Nhân viên y tế được đào tạo đặc biệt và thiết bị hồi sức sẵn có (bao gồm cả adrenaline) phải có mặt trong khi dùng thuốc. Tình trạng quá mẫn cấp tính hoặc có khả năng đe dọa tính mạng không thể kiểm soát này là chống chỉ định thử lại thuốc. Chế phẩm có chứa natri - nên thận trọng ở những bệnh nhân đang ăn kiêng với hàm lượng natri hạn chế. Chèn ép tủy sống, cũng ở vùng cổ tử cung, với bệnh lý tủy sau đó là một biến chứng nghiêm trọng và đã biết có thể gây ra bởi MPS VI - bệnh nhân cần được theo dõi các dấu hiệu và triệu chứng của chèn ép tủy sống (đau lưng, liệt dưới điểm đè, đại tiện không tự chủ nước tiểu và phân) và nếu cần, được chăm sóc thích hợp.
Hoạt động không mong muốn
Rất phổ biến: viêm họng, viêm dạ dày ruột, dị ứng, đau đầu, viêm kết mạc, mờ giác mạc, đau tai, khiếm thính, tăng huyết áp, khó thở, nghẹt mũi, đau bụng, thoát vị rốn, nôn, buồn nôn, phù mặt, phát ban , phát ban, ngứa, đau, đau ngực, ớn lạnh, khó chịu, sốt, đau khớp. Thường gặp: co giật, hạ huyết áp, ngừng thở, ho, suy hô hấp, hen suyễn, co thắt phế quản, ban đỏ. Không rõ: phản ứng phản vệ, sốc, loạn cảm, nhịp tim chậm, nhịp tim nhanh, tím tái, xanh xao, phù nề thanh quản, thiếu oxy, thở nhanh.
Mang thai và cho con bú
Thuốc không được sử dụng trong thời kỳ mang thai trừ khi cần thiết. Nên ngừng cho con bú trong thời gian điều trị bằng chế phẩm. Các nghiên cứu về sinh sản trên chuột và thỏ dùng thuốc với liều lên đến 3 mg / kg / ngày cho thấy không có bằng chứng về sự suy giảm khả năng sinh sản hoặc tác động có hại lên thai nhi do thuốc gây ra.
Chế phẩm có chứa chất: Galsulfase
Thuốc được hoàn lại: KHÔNG